生物分子具有能在溶液中電離并賦予分子特定凈電荷的官能團。例如,蛋白質由帶有氨基(-NH 2)和羧酸(-COOH)的官能團組成。蛋白質的3D結構決定了哪些氨基酸殘基暴露在其表面。根據介質的pH值,這些殘基被電離,使得分子表面帶有正負電荷。在低pH值下,更多的氨基被質子化,蛋白質分子帶有凈正電荷。另一方面,在較高的pH值下,更多的羧酸基團被去質子化,產生的陰離子使蛋白質分子表面帶負電荷。表面上離子化官能團的總數決定了表面凈電荷,每個分子在任何給定的pH值下都有唯一的表面凈電荷。蛋白質在其等電點(pI)是電中性的,等電點是一個特定的pH值,在該pH值下,分子上沒有凈電荷。
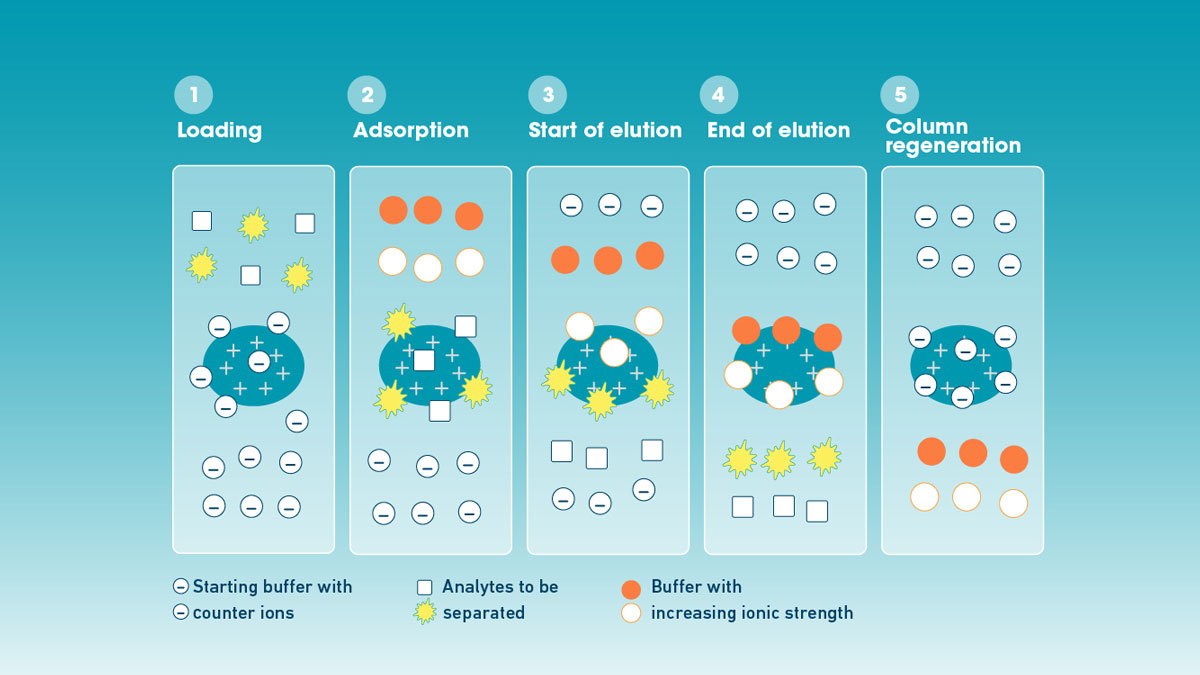
圖1顯示了IEX的分離機理。當極性或帶電分析物被裝載到離子交換柱中時,它們將靜電結合到固定相顆粒表面上的帶相反電荷的離子上。分析物分子表面的正電荷或負電荷越多,對固定相中帶相反電荷的顆粒的靜電吸引力越強。目標分析物的保留時間還取決于與固定相相互作用的次數。含有緩沖液和鹽的含水流動相用于通過改變pH值或離子強度來洗脫結合的分析物。
通過增加洗脫緩沖液的離子強度在IEX分離分析物的示意圖。從裝載、吸附和洗脫到柱再生結束,分子在柱中移動。
圖1:顯示通過增加洗脫緩沖液的離子強度在IEX中分離分析物的示意圖。
IEX過程有五個主要步驟:2
1.平衡——第一步,用初始緩沖液(初始緩沖液組合物)洗滌固定相,直到基線穩定并且洗脫液的pH值保持恒定。這一步驟確保了色譜柱上的可電離基團能夠與帶電的分析物分子相互作用。
2.上樣——將溶解在初始緩沖液或與初始緩沖液pH值相同的緩沖液中的樣品注入色譜柱。調節緩沖液的pH值和離子強度,使被分析物能與色譜柱結合,而雜質不能。
3.清洗 ——用初始緩沖液再次清洗色譜柱,以去除不帶電荷的分子和帶有與固定相相同電荷的分子。一旦雜質被洗掉,基線就會穩定下來。
4.洗脫——當洗脫緩沖液中的離子競爭并取代色譜柱表面帶電位置上的分析物時,鹽梯度用于洗脫結合的分析物。在低離子強度下,弱結合的分析物(表面電荷密度低的分子)開始從色譜柱中洗脫出來。隨著鹽濃度的增加,表面電荷密度越來越高的強結合分子依次從色譜柱上洗脫下來。或者,可以使用pH梯度洗脫結合的分析物,這些分析物以各自的pI值從柱中釋放出來。為了洗脫陽離子,增加洗脫緩沖液的pH,同時通過降低洗脫緩沖液的pH從陰離子交換柱中洗脫陰離子。如果分子在其pI值沉淀,則不能使用pH梯度。
5.色譜柱再生——最后,通過洗去結合在柱上的任何分子,柱的容量可以恢復用于下一次操作。因此,允許高離子強度緩沖液流經色譜柱,直到洗脫液的基線和pH值穩定。然后在下次運行前用初始緩沖液調整色譜柱。
雖然紫外線或熒光檢測器在IEX最常用,但也使用其他檢測器,如質譜儀、折光率(RI)或多角度光散射(MALS)檢測器。



